Ăltimas NotĂcias
Anvisa recebe pedido para uso de novo imunizante
A Agência Nacional de Vigilância Sanitária recebeu uma nova solicitação de autorização temporária de uso emergencial
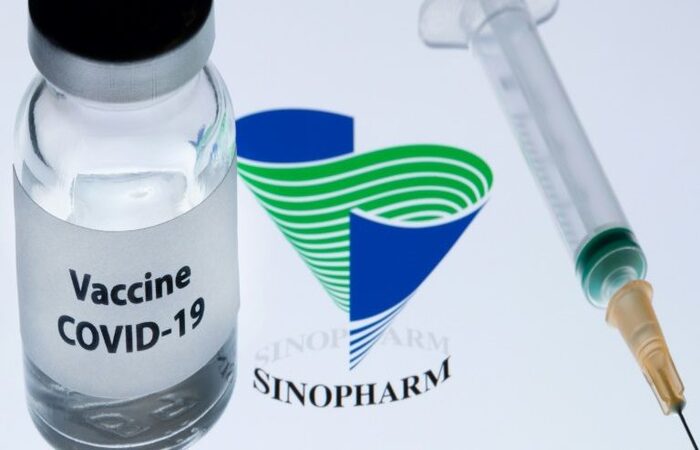
A AgĂȘncia Nacional de Vigilância SanitĂĄria (Anvisa) recebeu, nesta segunda-feira, 26, uma nova solicitação de autorização temporĂĄria de uso emergencial para vacina contra a Covid-19. Dessa vez, o pedido foi feito pelo laboratório chinĂȘs Sinopharm e apresentado pela empresa Blau FarmacĂȘutica, que representa o imunizante no Brasil.
TECNOLOGIA
A vacina da Sinopharm é produzida a partir de um vĂrus inativado. O imunizante é aplicado em duas doses, com um intervalo de trĂȘs a quatro semanas entre elas. O produto é recomendado para pessoas acima de 18 anos de idade, de acordo com os dados conhecidos até o momento.
"O desenvolvimento da vacina não teve estudos clĂnicos conduzidos no Brasil, o que não impede a submissão do pedido de autorização para uso emergencial ou registro na Anvisa. As pesquisas foram desenvolvidas em paĂses como Argentina, Peru, Emirados Árabes, Egito e China", explicou a Anvisa em nota.
Em maio, esse imunizante foi aprovado para uso emergencial pela Organização Mundial da SaĂșde (OMS).
PRAZOS
Segundo o protocolo da Anvisa, as primeiras 24 horas serão utilizadas para fazer uma triagem do processo e verificar se os documentos necessĂĄrios para avaliação estão disponĂveis. Se houver informações importantes faltando, a agĂȘncia pode solicitar as informações adicionais ao laboratório.
A anĂĄlise do pedido de uso emergencial é feita por uma equipe multidisciplinar que envolve especialistas das ĂĄreas de Registro, Monitoramento e Inspeção de Medicamentos.
De acordo com a Resolução da Diretoria Colegiada (RDC) 475/2021, que regulamenta o uso emergencial de vacinas, o prazo de anĂĄlise do pedido pode ser de sete ou 30 dias, a depender do caso especĂfico.
Pela norma, o prazo de avaliação serĂĄ de sete dias quando houver desenvolvimento clĂnico da vacina no Brasil ou quando o relatório ou parecer técnico emitido pela autoridade sanitĂĄria estrangeira seja capaz de comprovar que a vacina atende aos padrões de qualidade, de eficĂĄcia e de segurança estabelecidos pela OMS ou pelo ICH (Conselho Internacional para Harmonização de Requisitos Técnicos para Medicamentos de Uso Humano, do inglĂȘs International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use) e pelo PIC/S (Esquema de Cooperação em Inspeção FarmacĂȘutica, do inglĂȘs Pharmaceutical Inspection Co-operation Scheme).
Em casos em que não são realizados estudos clĂnicos da vacina no Brasil ou quando o relatório ou parecer técnico emitido pela autoridade sanitĂĄria estrangeira não for capaz de comprovar que a vacina atende aos padrões de qualidade, de eficĂĄcia e de segurança estabelecidos pela OMS ou pelo ICH e pelo PIC/S, o prazo serĂĄ de 30 dias.
O prazo de avaliação do pedido de uso emergencial não considera o tempo do processo em status de exigĂȘncia técnica, que é quando o laboratório precisa responder questões técnicas feitas pela agĂȘncia dentro do processo.
Fonte: AgĂȘncia Brasil