Últimas Notícias
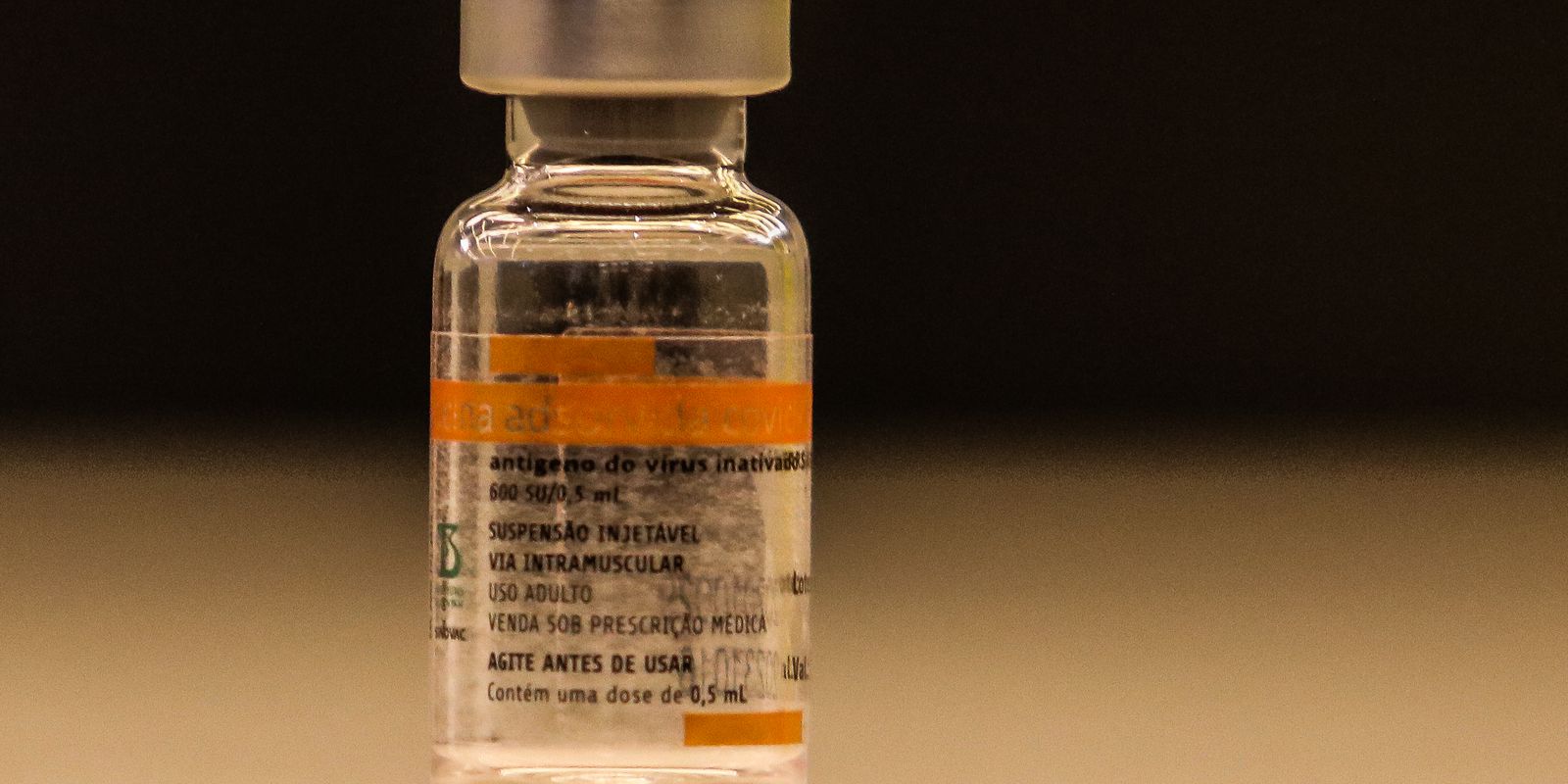
Anvisa interdita lotes da vacina CoronaVac
A Agência Nacional de Vigilância Sanitária determinou no dia 4 a interdição cautelar de lotes da CoronaVac, proibindo a distribuição e uso
A Ag√™ncia Nacional de Vigilância Sanit√°ria-Anvisa determinou nesta dia 4 a interdição cautelar de lotes da CoronaVac, proibindo a distribuição e uso de lotes que foram envasados em uma f√°brica não aprovada na autorização de uso emergencial da vacina. Em nota, a ag√™ncia explicou que, nesse caso, "configura-se em produto não regularizado junto à Anvisa", necessitando de atuação imediata para "mitigar um poss√≠vel risco sanit√°rio" à população. A medida foi publicada neste s√°bado em edição extra do Di√°rio Oficial da União.
BUTANTAN
Também em nota, o Instituto Butantan, que distribui a vacina no Brasil, esclareceu que a medida da Anvisa "não deve causar alarmismo". "Foi o próprio instituto que, por compromisso com a transpar√™ncia e por extrema precaução, comunicou o fato à ag√™ncia, após atestar a qualidade das doses recebidas. Isso garante que os imunizantes são seguros para a população", explicou.
De acordo com a Anvisa, o Instituto Butantan informou no dia 3 que o laboratório chin√™s Sinovac, fabricante da CoronaVac, enviou ao Brasil vacinas envasadas em uma unidade que não foi inspecionada nem aprovada pela ag√™ncia brasileira. São 25 lotes com um total de 12.113.934 de doses do imunizante. Outros 17 lotes envasados no mesmo local, com 9 milhões de doses, estão em tramitação de envio e liberação ao Brasil.
A interdição cautelar tem o prazo de 90 dias. A Anvisa informou que, durante esse per√≠odo, "trabalhar√° na avaliação das condições de boas pr√°ticas de fabricação da planta fabril não aprovada, no potencial impacto dessa alteração de local nos requisitos de qualidade, segurança e efic√°cia e do eventual impacto para as pessoas que foram vacinadas com esse lote".
Até o momento, segundo a ag√™ncia, não h√° relatórios de inspeção emitidos por outras autoridades de refer√™ncia, como o Esquema de Cooperação em Inspeção Farmac√™utica e a Organização Mundial de Sa√ļde .
CERTIFICAÇÃO
Além disso, o Instituto Butantan deve regularizar o novo local na cadeia de fabricação da vacina. O órgão informou que, h√° 15 dias, encaminhou à Anvisa toda a documentação necess√°ria para a certificação do processo de produção em que foram feitas as referidas doses. "Por isso, tem convicção que ela ser√° concedida em breve. Caso necess√°rio, pode complementar a solicitação com mais dados, inclusive da Sinovac, caso a ag√™ncia julgue necess√°rio", explicou, reafirmando que todas as doses estão atestadas pelo rigoroso controle de qualidade do Butantan.
A Anvisa esclareceu que, na autorização de uso emergencial do imunizante, aprovada em 17 de janeiro deste ano, consta que as vacinas devem ser "importadas prontas da Sinovac ou o granel da vacina formulada e estéril, sendo importado da Sinovac para envase e acondicionamento no Instituto Butantan. Entretanto, eventuais alterac?o?es nestas configurac?o?es devem passar por nova analise das √°reas técnicas da Anvisa".
Fonte: Agência Brasil